1.電池不同狀態下錳含量及化合價分析
然而,長期以來有關于 Mn 在電解液中的存在狀態及形成機理研究確一直沒有受到足夠重視。包括 Tarascon 在內許多人僅僅是合理的假設 Mn3+容易發生歧化反應,從而使得電解液中存在的主要是二價錳。
過去四十年間,大量的文獻報道了正負極有錳的存在,對電解液中主要存在的是 Mn2+傳統理論卻一直沒有受到質疑,同樣也沒有更系統的深入研究報道。
以色列鋰電大牛 Doron Aurbach(通訊作者)等人,使用鈷酸鋰石墨全電池在LiPF6(1M),EC:DMC=1:1 的電解液體系中進行一系列的電化學測試,采用 EPR, XNEAS,ICP 等測試手段證明電解液中 Mn 主要以 Mn3+的形態存在。
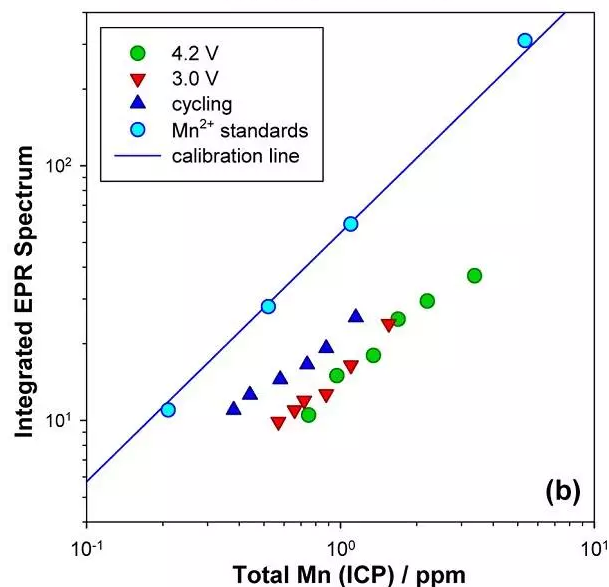
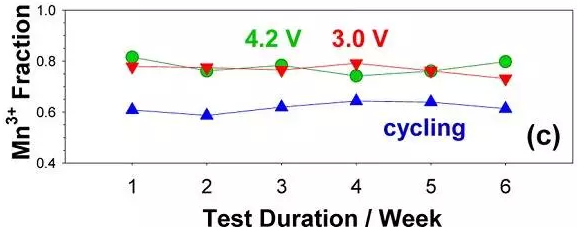
EPR 結合 ICP 數據結果表明,在滿電態(4.2V)以及貧電態(3.0V)電池中,電解液中三價錳占 80%,而在循環過程中電解液中三價錳只占 60%。同時,文章還證明在有機電解液體系中 Mn3+的歧化反應速率非常慢。
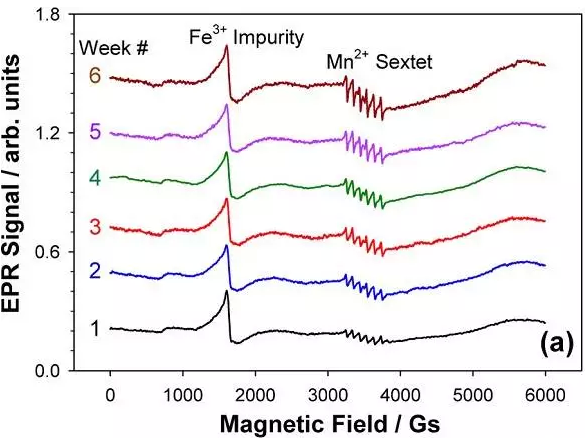
a) 鈷酸鋰石墨全電池滿電態(4.2v)維持 6 周電子自旋共振(EPR)信號圖,
b) EPR 以及 ICP 綜合圖。
C) 60℃高溫條件下,電池維持不同電壓,不同時間,電解液中 Mn3+的含量圖
2. 電解液中錳存在形態同步輻射表征
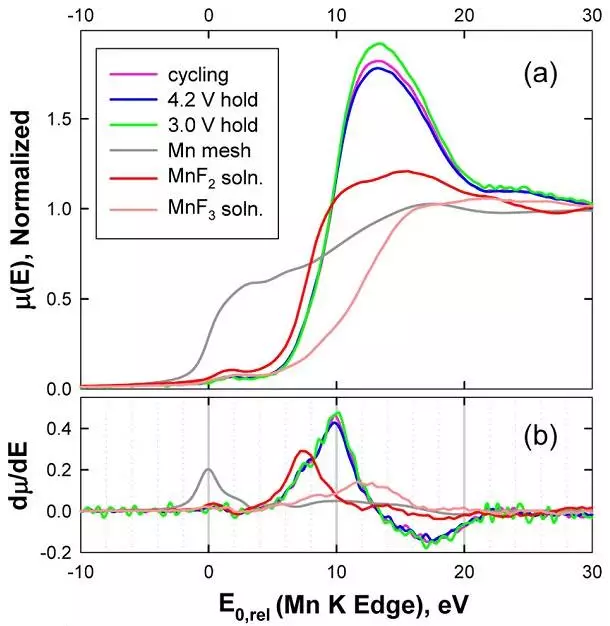
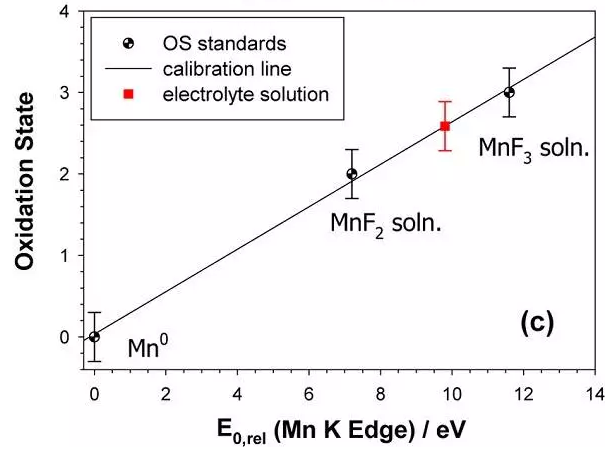
a) 三種氧化態標準(Mn, MnF2, MnF3)以及三種測試電池在EC:DEC=1:1 的電解液體系 XANES 光譜
b)XANES 光譜的能量的一階導數
c) 電化學 測試后在電解液中測試后在電解液中 Mn的平均氧化態
3 電池內錳的存在形態分析

電解液中 Mn 陽離子的三元形態圖
【小結】
團隊通過一系列的表征證明在商用六氟磷酸鋰電解液體系中,Mn 主要以Mn3+的形態存在,其量的多少取決于電化學測試條件。Mn3+ 和 Mn4+ 在電解液中相似的溶解度,LMO 是否豐富及充電狀態不同等因素影響會導致出現不同的測試結果,作者假設 Mn3+比 Mn2+具有更高的溶劑穩定性,使得歧化反應速率緩慢,導致溶液中 Mn3+占據主導。
作者的結論與之前傳統的 Mn2+占主導理論相違背。與此同時,作者發現,錳酸鋰正極中錳溶出的主要機理是 Mn3+的歧化反應,這也許同樣適用于其他尖晶石相正極材料。






